Commémoratifs et anamèse
Gala est un chat femelle non-stérilisée, de race Maine Coon, d’environ 3 mois.
Gala présente des croûtes qui sont apparues à l’intérieur de la cuisse et qui se sont étendues à l’ensemble du corps en une semaine. Elle présente également un prurit marqué qui s’intensifie au fur et à mesure de l’extension des lésions. Gala est par ailleurs de plus en plus fatiguée.
Gala a été adoptée dans un élevage moins d’un mois auparavant. Elle vit en maison avec accès à l’extérieur. Elle mange une ration industrielle pour chaton, donnée par l’éleveur. Elle a reçu sa primo vaccination et une pipette de sélamectine en spot on (Stronghold®) la veille de son adoption, chez l’éleveur.
Après questionnement, la petite fille de la famille présente une lésion érythémateuse circinée sur l’abdomen.
Bon à savoir:
- la détermination de la prévalence et de la prédisposition raciale est difficile à évaluer.
- les dermatophytoses sous-cutanées ont été rapportées essentiellement chez le chien Yorkshire Terrier et le chat Persan.
- les activités de chasse et de travail augmentent le risque d’exposition aux spores de dermatophytes et donc de dermatophytose cutanée superficielle ou nodulaire.
- les rétroviroses félines (FIV et/ou FeLV) de chat isolé n’augmentent pas le risque de contamination.
Examen clinique dermatologique
Examen à distance
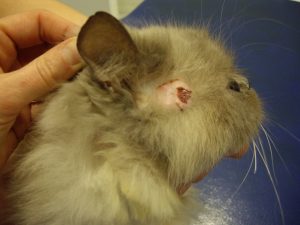
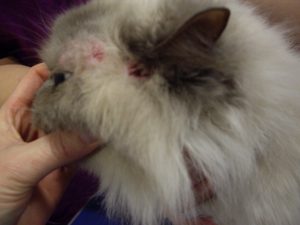
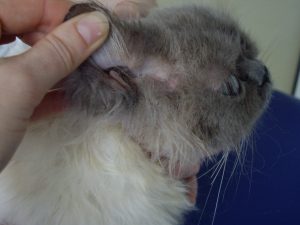
Gala présente des lésions nummulaires alopéciques réparties sur l’ensemble du corps : la face, le crâne, le tronc, le ventre, la face interne des membres et la queue.
-
Examen dermatologique rapproché
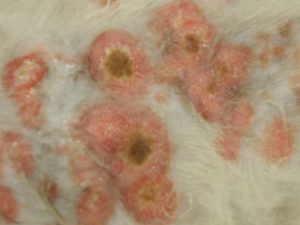
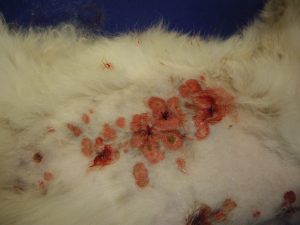
Les lésions observées sont toutes similaires : ce sont des lésions nummulaires érythémateuses, très squameuses voire croûteuses et alopéciques. Elles sont parfois coalescentes formant des de larges zones, particulièrement en région ventrale.
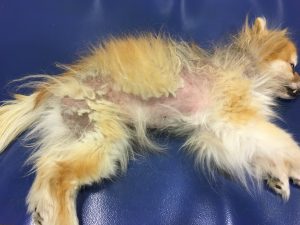
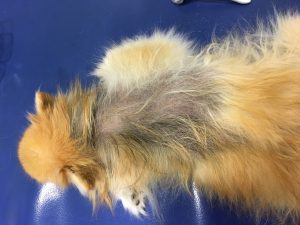
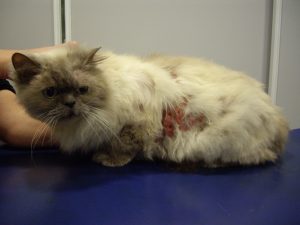
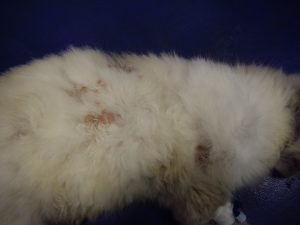
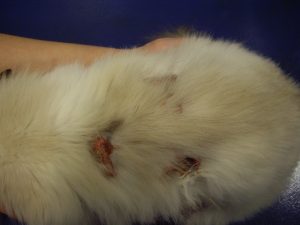
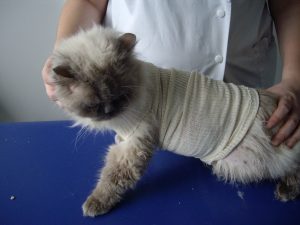
Gala a été tranquillisée pour permettre une tonte du corps afin de mieux visualiser l’étendue des lésions (photos 1 et 2).
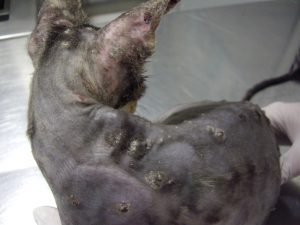
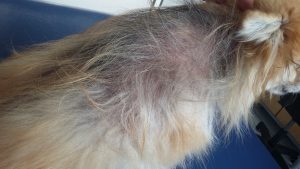
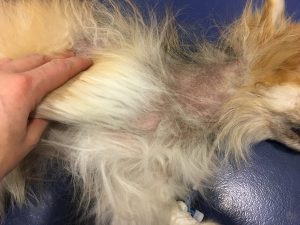
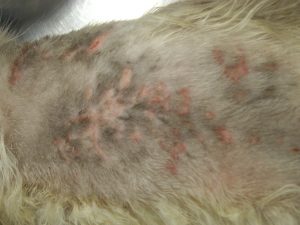
Photo n° 1 : Vue rapprochée de la région dorsale après tonte. Notez ces lésions nummulaires squamo-croûteuses.
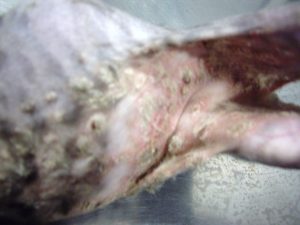
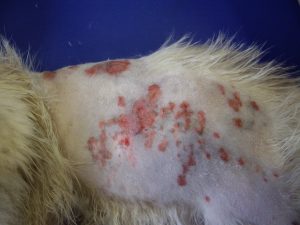
Photo n°2 : Vue rapprochée de la région ventrale après tonte. Notez les larges zones érythémateuses et squameuses.
Gala présente une dermatose aiguë, secondairement et fortement prurigineuse, extensive, multifocale, intéressant la tête, dos, le ventre, les grands plis, la queue avec des lésions nummulaires érythémateuses et alopéciques et squamo-croûteuses, parfois coalescentes.
Hypothèses diagnostiques
- Dermatophytose
- Ectoparasitose (Cheyletiellose, Trombiculose, Démodécie)
- Complication infectieuse secondaire (bactérienne ou fongique)
- Dermatose allergique (DAPP, HS alimentaire ou Syndrome Atopique Félin)
Examens complémentaires réalisés
- Examen en lumière de Wood: l’examen révèle des zones fluorescentes jaune-vert en bâtonnets à la base des poils caractéristiques sur toutes les lésions observées. Le résultat est positif.
Bon à savoir sur la lumière de Wood:
- Seul Microsporum canis entraîne une fluorescence due à la ptéridine synthétisée dans le cortex ou la medulla de la tige pilaire.
- La fluorescence est observé surtout la quasi totalité des cas à Microsporum canis.
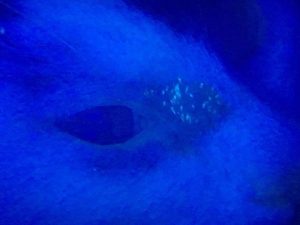
- La fluorescence doit être verte, en forme de bâton autour de la base de la tige pilaire, et non jaune comme apparaît les exsudats. Attention aux faux positifs!
- Les traitements topiques n’effacent pas artificiellement la fluorescence.
- Test à la cellophane adhésive: l’examen ne montre aucun élément figuré, seulement des polynucléaires neutrophiles dégénérés.
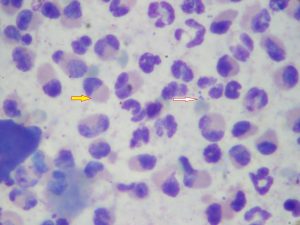
- Examen direct de poils (trichogramme): l’examen permet l’observation de spores réfringentes en amas autour de la racine du poil et des filaments mycéliens (photo n°3).
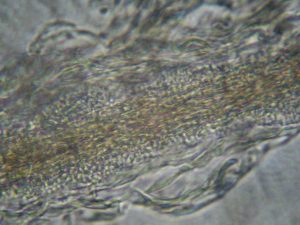
Photo 3: racine d’un poil teigneux, grossissement x40. Notez la présence d’éléments mycéliens et de spores en amas autour du poil. La structure du poil n’est plus conservée.
- Culture fongique: échantillon envoyé au laboratoire d’analyses de dermatologie, parasitologie et mycologie d’ONIRIS: après ensemencement sur milieu de Sabouraud-Chloramphénicol-Actidione (SCA) et incubation à 27°C pendant 7 jours, 13 colonies de Microsporum canis se sont développées dès le septième jour.
Bon à savoir:
- Il n’y a pas de test « gold standard » mais une combinaison de plusieurs tests complémentaires.
- Le prélèvement pour le laboratoire peut être réalisé avec une moquette stérile, une brosse à dent stérile, des poils ou le produit d’un raclage cutané.
- Les milieux de culture DTM (observation d’une pousse d’hyphes et d’un changement de couleur du support dans un certains délai) à réaliser à la clinique sont à utiliser avec précaution. En effet, ils sont sources de nombreux faux-positifs: certains contaminants fongiques possèdent les mêmes caractéristiques que les dermatophytes. Un diagnostic de certitude doit passer par la technique du drapeau de Roth: (observation au microscope des conidies et diagnose d’espèce) ce qui demande une certaine expérience.
- Quelque soit la méthode de diagnostic, les faux-positifs et faux-négatifs sont dus à une mauvaise manipulation, un mauvais équipement, un défaut d’expérience ou une mauvaise technique.
Conclusion:
Gala est atteinte de dermatophytie à Microsporum canis.
Traitement:
- Tonte de l’animal
Préalablement à la mise en place du traitement, l’animal atteint doit être tondu en observant des précautions particulières pour le manipulateur : port de gants, de blouse intégrale, de lunettes, et la tonte s’effectue sur un sac plastique type sac poubelle ouvert afin de récolter un maximum de poils infectés tondus. Le matériel sera par la suite désinfecté avec une solution adéquate, et les instruments seront passés à l’autoclave. La tonte permet de diminuer la charge parasitaire et de faciliter l’application des topiques.
-
Traitement topique
La seule molécule à la fois efficace et qui possède une AMM pour le chat dans cette indication est l’énilconazole (Imaveral®). La solution est diluée à 0.2% dans de l’eau et appliquée avec un brossage sur tout le corps de l’animal, à raison de 2 fois par semaine pendant plusieurs semaines (au moins 4, voire 6). Ce traitement est à appliquer sur l’animal présentant des lésions mais aussi sur les congénères asymptomatiques.
Bon à savoir:
- Le miconazole, sous forme de shampooing à 2% associé à la chlorexidine (Malaseb®), ne possède pas d’AMM pour les dermatophytoses mais sont reconnus efficaces.
- les shampoings au miconazole sont efficaces in vitro mais in vivo, il est reconnu efficace lorsqu’il est couplé à la chlorexidine.
- La chlorexidine seule est inefficace.
- Le traitement topique ne doit pas être considéré comme une monothérapie, mais être couplé à une thérapie systémique, même pour les formes localisées.
-
Traitement systémique
Le traitement antifongique externe choisi est l’énilconazole (IMAVERAL®), à raison de 2 bains par semaine pendant 1 mois. Le produit est appliqué à l’aide d’un gant ou une éponge imbibée, est laissé posé quelques minutes puis est rincé afin de limiter l’ingestion du produit.
Le traitement systémique choisi est l’itraconazole (ITRAFUNGOL®) à la dose préconisée de 5 mg/Kg/j par voie orale, en cures de 3 fois une semaine avec un arrêt du traitement d’une semaine entre chaque cure d’administration.
Le traitement du milieu extérieur choisi est CLINAFARM® en pulvérisations.
Gala doit également être confinée à l’intérieur.
Bon à savoir:
- Un référentiel a été proposé par le groupe d’étude en dermatologie des animaux de compagnie (GEDAC ). lien vers l’article ici.
- L’itraconnazole, le kétoconazole et la gréiséofulvine sont les traitements systémiques les plus efficaces contre les dermatophytes. Une meilleure tolérance est observée pour l’itraconazole et certaines contre-indications sont à respecter pour la griséofulvine.
- Le luféuron n’est pas efficace in vitro contre les dermatophytes, ne prévient pas et n’altère pas la progression de l’infection, ne potentialise pas les autres traitements systémiques, et n’a aucune place dans l’arsenal thérapeutique contre les dermatophytes.
- le traitement de l’environnement permet d’empêcher une nouvelle contamination.
Suivi
-
J + 5 semaines
L’évolution clinique est favorable : le prurit est moins intense. Gala a retrouvé son comportement habituel de chaton. Les lésions s’améliorent : elles sont moins croûteuses sur la ligne du dos et le ventre, l’érythème est très atténué sur le ventre, quelques squamo-croûtes persistent sur la face, le dos et le périnée (photo 4 et 5).
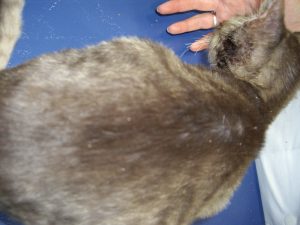
Photo 4 : vue de la région dorsale après 5 semaines de traitement. Des lésions squamo-crouteuses persistent sur le dos.
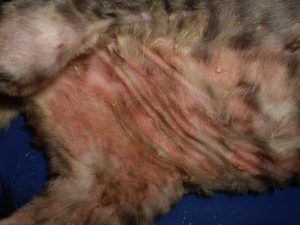
Photo 5 : vue de la région ventrale après 5 semaines de traitement. L’érythème est atténué et les squamo-croûtes ont très nettement régressé.
Il est décidé de prolonger les traitements topiques et systémiques encore 3 semaines (2 semaines d’administration d’itraconazole).
-
J+ 9 semaines
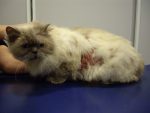
Gala ne présente plus de lésion sur aucune partie du corps (photo 6). Le pelage repousse normalement. L’examen en lumière de Wood est négativé et le trichogramme ne montre plus d’image d’invasion des tiges pilaires.

Photo 6 : Gala après 8 semaines de traitement. Le poil a repoussé et elle ne présente plus aucune lésion.
Il est donc décidé d’arrêter tout traitement et de réaliser une culture fongique 2 semaines plus tard.
Le prélèvement est réalisé à l’emplacement d’anciennes traces lésionnelles du dos à l’aide d’un carré de moquette stérile. Le résultat nous révèle l’absence de dermatophyte.
Discussion
Les dermatophytoses du chien et du chat sont des dermatoses fongiques fréquentes et transmissibles à l’Homme. Elles sont principalement causées par Microsporum canis, et occasionnellement par Trichophyton.
Les dermatophytoses sont extrêmement contagieuses. Le chat se contamine soit par contact direct avec un autre animal infecté, soit par l’intermédiaire de l’environnement qui représente un réservoir de spores. En fonction des conditions ambiantes, les spores peuvent rester infectantes pendant plusieurs mois [2].
L’éleveuse de Gala a été informée du diagnostic de dermatophytie par la propriétaire à la réception des résultats de la culture mycologique. Elle affirme ne jamais avoir eu de problème de cette nature dans son élevage et ne désire pas que nous prenions contact avoir son vétérinaire traitant. Gala n’ayant eu aucun contact avec d’autres animaux depuis son acquisition, on peut penser que la contamination a pourtant eu lieu dans l’élevage. La contamination des congénères, le cas échéant, doit toujours être envisagée.
Les dermatophyties se caractérisent par des formes cliniques très variées. La forme clinique la plus typique est la dépilation nummulaire d’évolution centrifuge, associée à des squames, des croûtes et parfois de l’érythème. Le prurit est d’intensité variable. Chez Gala, c’est le signe qui a alerté sa propriétaire, puis elle a remarqué les premières lésions cutanées. Elle présentait effectivement une forme clinique très typique.
La contamination humaine est très fréquente, tout particulièrement chez la femme, l’enfant et les sujets immunodéprimés. Le cas échéant, elle constitue une aide précieuse au diagnostic, ce qui a été le cas pour Gala. La petite fille de la famille n’en avait pas parlé à sa maman, et c’est au cours de la consultation que sa lésion a été montrée. Les propriétaires doivent être informés de ce risque de contamination aux autres animaux et à l’homme.
Le diagnostic repose sur l’examen à la lampe de Wood, la mise en évidence d’éléments fongiques par l’examen direct de poils et de squames au microscope et la culture fongique pour l’identification du champignon en cause.
L’examen à la lumière de Wood est seulement évocateur d’une dermatophytie à Microsporum canis mais n’est pas diagnostique. La fluorescence indique la présence de produits de substances fongiques altérées dans les poils (ptéridine) et permet de suspecter une dermatophytie, sans prouver la présence de spores. Les poils fluorescents doivent faire l’objet d’un examen microscopique direct et d’une culture fongique [5].
L’examen direct des poils ou de squames nécessite du temps et un œil aguerri. L’examen est facilité lorsque les poils sont prélevés en zone fluorescente, et déposés dans une goutte d’agent éclaircissant comme le lactophénol. Avec un peu d’expérience, cette méthode est assez sensible et permet souvent d’initier un traitement avant l’obtention du résultat de la culture fongique [1, 2, 5].
La culture fongique demeure la méthode de choix qui permet un diagnostic définitif et l’identification précise du champignon mis en cause, et de ce fait, d’obtenir un pronostic quant à la réponse au traitement. Le recours à un laboratoire spécialisé en mycologie est vivement recommandé pour éviter les erreurs d’interprétation comme lors d’utilisation des milieux de culture avec indicateurs de pH vendus par les centrales par exemple [1, 2, 5].
Dans notre cas, les 3 conditions sont réunies : l’examen en lumière de Wood est positif, le trichogramme est très caractéristique et la culture fongique nous donne une réponse compatible avec la clinique.
Les traitements antifongiques topiques et systémiques doivent être associés. Le traitement systémique vise à accélérer la résolution des signes cliniques et le traitement topique à diminuer le risque de contagion et de dissémination dans l’environnement. Le traitement doit durer au moins 4 à 6 semaines. Les corticoïdes sont contre-indiqués. Les animaux atteints doivent être isolés des autres. Une décontamination rigoureuse de l’environnement doit être réalisée. Dans le cas de Gala, l’ensemble des modalités du traitement a été effectué.
L’itraconazole a été choisi pour son innocuité, son AMM dans cette espèce et dans cette indication, et pour sa présentation sous forme de solution buvable. De nombreuses publications ont démontré son efficacité et sa meilleure tolérance, même si la griséofulvine reste une référence historique. Le coût n’a pas été un frein pour la propriétaire [3, 4].
Très lipophile, l’itraconazole d’abord accumulé dans les glandes sébacées, est rapidement redistribué par le sébum. L’accumulation de l’itraconazole dans la peau, dans les poils et les glandes sébacées constitue un réservoir thérapeutique et rend possible une administration par semaine alternée. Trois semaines d’administration correspondent à 7 semaines d’efficacité du produit. Ce type d’administration très original est un avantage puisqu’il permet de réduire le coût du traitement, mais qui reste supérieur au coût des autres molécules. Il faut cependant veiller à bien expliquer au propriétaire sous peine d’erreur d’observance [3, 4]. Gala a reçu en tout 5 semaines d’administration d’itraconazole. En effet, la culture fongique à révélé de nombreuse colonies, rendant le traitement possiblement plus long. De plus, à la fin des 3 semaines d’administration en semaines alternées, Gala présentait toujours de signes cliniques. Il a donc été décidé de continuer l’itraconazole afin d’administrer le traitement systémique au-delà de la guérison clinique.
L’évaluation du traitement doit être méthodique. La guérison clinique survient bien avant la guérison mycologique. Le chat doit être traité deux semaines au-delà de la guérison clinique. Une culture fongique est réalisée après 2 semaines d’arrêt de tout traitement. L’examen en lumière de Wood peut être utilisé pour suivre la guérison mycologique, mais doit être confirmé par une culture fongique de contrôle.
Bibliographie
- MORIELLO K. A. et al. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol 2017; 28: 266-303.
- E. Bensignor, C. Darmon-Hadjaje, N. Faivre-Cochet, P.-A. Germain, Pour le conseil
scientifique du GEDAC, Groupe d’étude en dermatologie des animaux de compagnie de l’Association française des vétérinaires pour animaux de compagnie (AFVAC). Revue vétérinaire clinique (2014) 49, 87—92.
- GUAGUERE E., PRELAUD P. Guide pratique de dermatologie féline. Edition MERIAL, Paris, 2000, 200 p.
- GUILLOT J. Infections fongiques : actualités thérapeutiques. Prat. Vet. 2010, vol 45, 638-642.
- MANCIANTI F. et coll. Efficacity of oral administration of itraconazole to cats with dermatophytosis caused by Microsporum caninum. JAVMA, 1998, vol 213, n°7, 993-995.
- MIGNON B. Dermatophytoses: actualités épidémiologiques et diagnostiques. Prat. Vet., 2010, n° spécial dermatologie, 54-60.
- VANDAEL E. Dermatophytoses félines: l’itraconazole quitte la réserve hospitalière. Le Point Vétérinaire, 2005, n°253, 14-15.